您是人體基因編輯的專家,去年發生基因編輯寶寶的爭議,您怎麼看?
您是人體基因編輯的專家,去年發生基因編輯寶寶的爭議,您怎麼看?
「基因編輯寶寶事件」是中國生物學家賀建奎和他的團隊,利用 CRISPR 技術,修改人類受精卵的 CCR5 基因,目的是讓胚胎在發育過程中對愛滋病毒免疫。
2018 年 11 月,賀建奎宣稱:已有一對基因經過編輯的雙胞胎姊妹誕生。這對姊妹的父親是愛滋病帶原者,但兩姊妹出生後證實均未感染愛滋。
圖│iStock
 寶寶不會感染愛滋,聽起來很棒啊,為什麼全世界科學家都跳腳?
寶寶不會感染愛滋,聽起來很棒啊,為什麼全世界科學家都跳腳?
主要原因有三:
一、這個實驗是沒有必要的冒險!當夫妻一方感染愛滋病,又想要生下健康寶寶,可以有更好、更安全的醫療方案,不需要進行風險還很大的基因編輯。
二、這次基因編輯的雙胞胎,只有一個實驗成功,另一顆受精卵雖然也放入 CRISPR ,卻沒有切掉 CCR5 基因。但是,賀建奎竟將這顆實驗失敗的受精卵,也放到母體孕育,這讓科學界無法接受!
因為這顆失敗的受精卵,不但沒有達到抗愛滋的醫療初衷,出生的寶寶還必須承受巨大的風險。如果 CRISPR 剪到其他基因,可能為這個新生命帶來難以承受的後果。
三、雖然剔除基因 CCR5 可能抵抗愛滋病毒,但這個基因會不會有其他重要、人類還沒發現的功能?剪掉這個基因會不會造成嚴重的副作用?目前的科學仍無法預料。
 看來基因編輯寶寶現階段還是母湯啊!您目前在改造人類的什麼基因呢?
看來基因編輯寶寶現階段還是母湯啊!您目前在改造人類的什麼基因呢?
CRISPR 門檻很低,許多人很快跑到應用面。但我比較關心安全性、副作用等問題。
在細胞裡丟進一把剪刀和 DNA,難道細胞完全沒反應嗎?我不太相信。
最近我的實驗室發現,細胞對外來 DNA 跟 RNA 的免疫反應很激烈:細胞會認出這些 RNA 跟 DNA 不是自己的,產生發炎反應,甚至放出求救訊號:「有奇怪的 RNA 或 DNA 出現!」如果細胞會對 CRISPR 出現發炎反應,未來想在活體上進行治療,問題就很大。
另一個重要的問題:雖然現在有一把精準有效的基因剪刀,但修復過程是細胞在控制,跟剪刀一點關係都沒有。理想狀況下,當 Cas9 剪開 DNA 時,會有機會更改 DNA,但細胞願不願意將正確的 DNA 片段接上去?當細胞已出現發炎反應,它會怎麼修復 DNA?目前仍沒辦法掌握。
 細胞會怎麼修復自己的 DNA?
細胞會怎麼修復自己的 DNA?
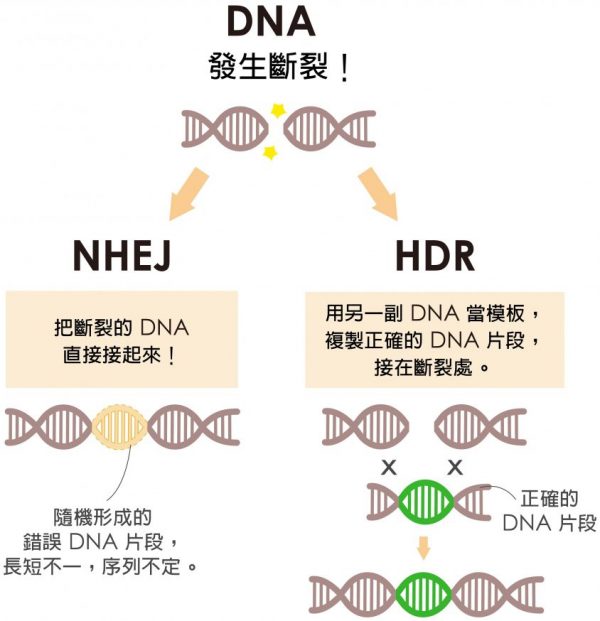
最重要的DNA 修復方式有兩種:
一種是非同源性末端結合 (NHEJ):直接將 DNA 雙股斷裂的尾端拉近、黏上。如果細胞選擇這條路,就不會接受外來的 DNA 片段。
一種是同源性重組 (HDR):正常的 DNA 有兩副,今天斷在某一副的某個位置,另一副通常不會這麼巧合斷在同一個位置,可以作為修復模板,複製一段正確 DNA,接在 DNA 的斷口處。
圖│研之有物 (資料來源│凌嘉鴻)
當細胞選擇走 HDR 這條路,才有可能接受接受我們送進去的 DNA 片段,完成基因編輯。可惜的是,細胞喜歡走 NHEJ,直接把斷掉的 DNA 兩端接起來,雖然這條路很有效率,但 DNA 序列容易多一些或少一些,影響蛋白質的合成。
 細胞為什麼會喜歡容易出錯的修補方式呢?
細胞為什麼會喜歡容易出錯的修補方式呢?
原因可能是:人體 65 億個鹼基序列上,真正存放基因的只有 1~2%,其他 98% 還不清楚有什麼功能。細胞的概念是:DNA 斷在不重要的位置的機率比較高,直接接上至少快。
HDR 雖然可以精準複製 DNA,但其實更危險。因為基因體序列重複性高,胡亂交換 DNA 片段的機率也很高,所以很多細胞寧可不走這條路。
總而言之,每種細胞面對 CRISPR 的反應不太一樣,有些細胞的開關是 HDR 一半、NHEJ 一半。幹細胞或一些免疫細胞,完全是 NHEJ。我們會特地選一些喜歡 NHEJ 的人體細胞做研究,了解細胞做決定的關鍵因素。
圖│研之有物
 未來 CRISPR 會怎麼治療人體?有可能做成藥劑嗎?
未來 CRISPR 會怎麼治療人體?有可能做成藥劑嗎?
這是另一個技術瓶頸!CRISPR一定要成為藥劑,才能廣泛使用。例如:當病人的心臟有基因突變,不需開刀剖開心臟,只要將 CRISPR 包入膠囊吃下去,或是注射入血液,經過血液循環系統,就能抵達生病的心臟細胞進行治療。
但這麼一來, CRISPR 必須能「精準」傳送到需要治療的細胞,就像寄包裹,必須抵達正確的地址。
目前最簡單的構想是:用一層膜包起 Cas9 跟 RNA,膜上有一些結構,能夠辨識特定的人體細胞。當這個「包裹」進入血液、組織、器官,找到正確目標(正確地址),才會把 Cas9 跟 RNA 送進細胞。
有人嘗試用病毒來「包裝」 Cas9 與運送,因為大自然中有很多病毒專門攻擊某個生物或器官。有人選擇用奈米材質的包裹,例如:有人的肌肉細胞基因突變,可以把奈米材質包裹注射到肌肉附近,讓它局部擴散,至少可治療某區的細胞。
雖然 CRISPR 比過去的基因剪刀好用多了,但這把剪刀的精準度、後續的細胞反應、DNA 修復方式以及藥物傳送問題……統統需要研究。我希望把 CRISPR 改到沒有副作用,精準、完全交換到正確的 DNA。
 如果 CRISPR 沒有副作用、可以做成藥劑,就可以打造完美寶寶嗎?
如果 CRISPR 沒有副作用、可以做成藥劑,就可以打造完美寶寶嗎?
技術上還是不可能!CRISPR 只是一把精準的基因剪刀,你得告訴它要剪什麼基因。上面說過,我們對人類基因體的了解不夠,可說是非常淺薄,光是改個身高,到底涉及哪些基因?它們怎麼運作?機制完全不清楚。
更重要的是,一個基因在成長各個階段會扮演不同的角色,或在不同細胞有不同功能,把這些基因一口氣改掉,有什麼影響?會不會有危險?我們都不知道。
另外,許多技術在研究室都可以做,但要應用到人類醫療,會有很多道德問題,這個底線應該是整個社會一起討論,不是科學家決定。
舉例來說:每個孕婦都會做產檢,如果產前就知道寶寶有基因缺陷,每位媽媽一定都會希望在受精卵或胚胎上修好寶寶的基因,以免寶貝出生後受苦。
這條底線可以繼續往前推:未來地球會越來越髒亂、氣候異常,小孩更容易罹癌。有些基因就算沒突變,是不是也能預防重於治療,先改得好一點?
總之,你可以有種種理由推進這條底線,但推到怎樣才算過頭?身高、眼睛、頭髮,什麼都要改嗎?難道真的要改成超級人種?
另外,這些技術絕對很昂貴,只有少數人負擔得起。
如果富人能隨意改東改西的話,可能更不怕生病,活得更久,或是具特殊優勢。那麼,憑什麼他們可以使用,其他人卻不行?
我認為罕見疾病或致命疾病應該治療,千萬不要走向超級人類或完美寶寶,造成不公平,但這是政府、國家必須立法規範的。
 您博士班學的是基礎微生物學,後來為什麼會轉向人體基因編輯研究?
您博士班學的是基礎微生物學,後來為什麼會轉向人體基因編輯研究?
完全是誤打誤撞(哈哈)。原本我在博士班是研究細菌怎麼合成天然物,有次 CRISPR 發明人之一的道納 (Jennifer A. Doudna) 博士到我們學校演講,內容是解蛋白質結構的生化技術。
我對這個主題很感興趣,主動寄信問道納博士能否到她實驗室做研究。面試時,她提到發現 CRISPR 是細菌的免疫機制,剛好我是念微生物學,可以幫得上忙,於是順利錄取了。
沒想到,我正式加入她的實驗室時,碰巧遇上 CRISPR 和 Cas9 研究大突破,成為最熱門的基因編輯技術。結果,面試的東西完全撇在一邊,我也投入基因編輯的研究。那時每天都很忙碌、很像坐雲霄飛車,但非常值得,畢竟這種見證歷史的機會很難得。
 您對人體基因編輯還有什麼建議嗎?
您對人體基因編輯還有什麼建議嗎?
請社會大眾不要只是直覺基因編輯好美好、或多可怕,可以多多了解相關知識。有了正確的知識,才能判斷它的底線應該劃在哪裡。
另外,CRISPR 仍有很多瓶頸有待突破,讓這項技術更精準、更安全,這需要很多科學家一起努力,徹底了解這把剪刀,把它改得更好。
最後,我覺得基礎科學很重要,還有很多東西等待發現。
試想,如果過去科學家不曾研究細菌免疫學,就無法發現 CRISPR了。唯有我們對基礎生物學夠了解,才能繼續發現新東西。

圖│研之有物