為酵素拍張藝術照
2019 年 4 月,中研院生化所特聘研究員蔡明道院士和中央大學生命科學系陳青諭助理教授的研究團隊,在《美國化學學會期刊》(Journal of the American Chemical Society),發表了研究團隊如何運用冷凍電子顯微術,揭示酵素在原子尺度的結構。
這是國際上第一篇利用高解析度冷凍電顯技術來探討酶學的論文,期刊並將此次研究成果選為當期封面,呈現出宛如藝術品的蛋白質酵素 3D 立體結構圖。

圖│《美國化學學會期刊》(Journal of the American Chemical Society)
冷凍電子顯微術( Cryo-electron microscopy, cryo-EM),是今日結構生物學研究最重要的技術突破。百年來,生物學家逐漸了解蛋白質、脂、核酸與醣等生物分子對生命運作的影響與機制,但過去缺乏原子級解析度的觀測工具,大大限制了生物學家的「視野」。
近半世紀,觀測技術不斷突破,構築了結構生物學一窺生命奧秘的諸多觀測方法,像 X 射線晶體學、核磁共振光譜法,以及質譜法,各有優缺點。冷凍電子顯微術以其原子級的解析力,成為最受期待的觀測神器!
結構生物學的新「視」界:冷凍電顯技術
在過去,研究者想要看到高解析度的微觀世界,電子顯微鏡絕對是不二選擇。因為電子波長比可見光還短,使解析度可高於光學顯微鏡,甚至能看見個別原子的位置。
可惜的是,電子顯微鏡也有限度!它使用高強度的電子束照射樣本,還要讓樣本處在真空環境中,導致生物分子會嚴重變質,無法觀測。 2017 年諾貝爾化學獎冷凍電顯技術,正可突破電子顯微術的問題。
冷凍電顯技術的問世,起源於蘇格蘭學者韓德森 (Richard Henderson) 以電子束觀測蛋白質「菌紫質」 。他利用留在細胞膜內的菌紫質不易因真空環境乾掉變形,以及在液態氮的冷凍環境下樣本不易受到電子束破壞的特性,証明了冷凍電顯技術可以用來觀測生物分子,並提供足以媲美 X 射線晶體學的解析度。
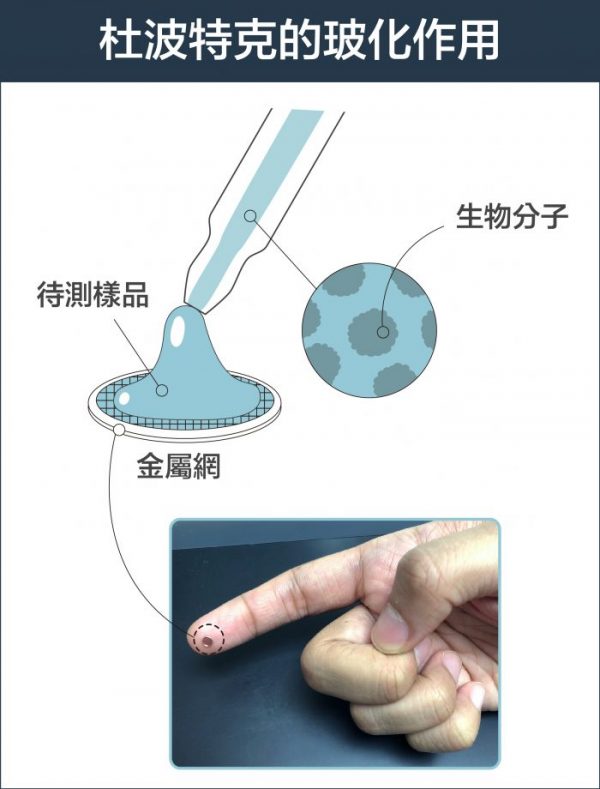
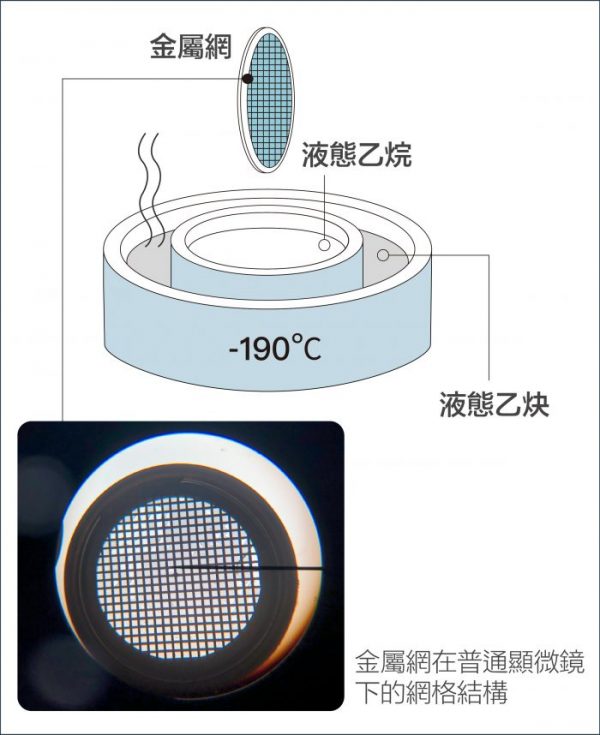
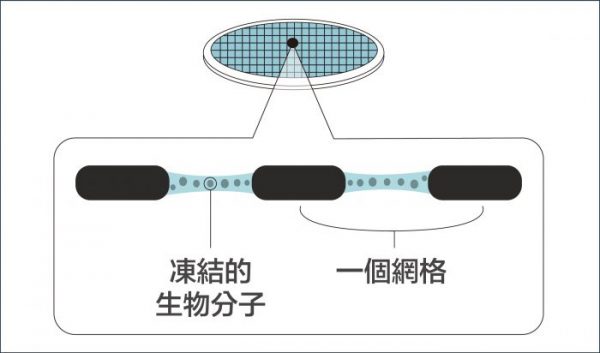
瑞士學者杜波克特 (Jacques Dubochet) 進一步改善冷凍環境!他的設計是:先將液體樣本鋪在金屬網格上,形成如泡沫一般的薄膜,再將薄膜浸入攝氏負 190 度的液態乙烷。這時樣本中的水會變成「玻化水」 ,意思是水凝固時不會產生冰晶干擾觀測,而是形成無結晶的玻璃化狀態。如此一來,就算將樣本放在真空的環境,也不會影響到樣本的結構。
圖│研之有物 (資料來源│pdf)
圖│研之有物 (資料來源│pdf)
圖│研之有物 (資料來源│pdf)
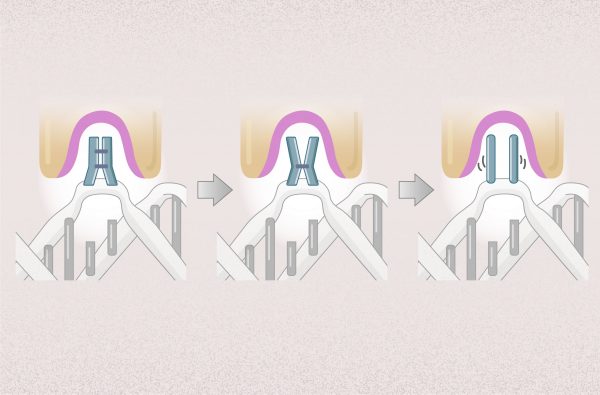
把樣本薄膜化,再急速冷凍,就彷彿按下時間暫停器, 使生物分子保持在凍結前一刻的結構。研究者可先將生物材料調整到想觀測的環境條件下,例如:給予不同的酸鹼值,不同的反應時間,再透過急速冷凍保持其結構,就能針對同一生物分子,觀察它在不同生化機制進程的結構變化。
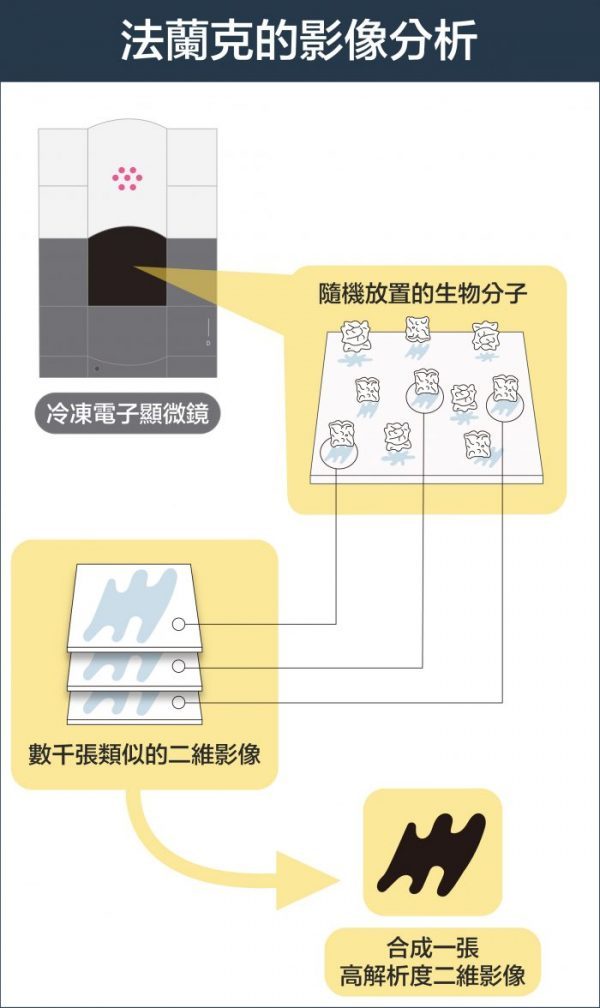
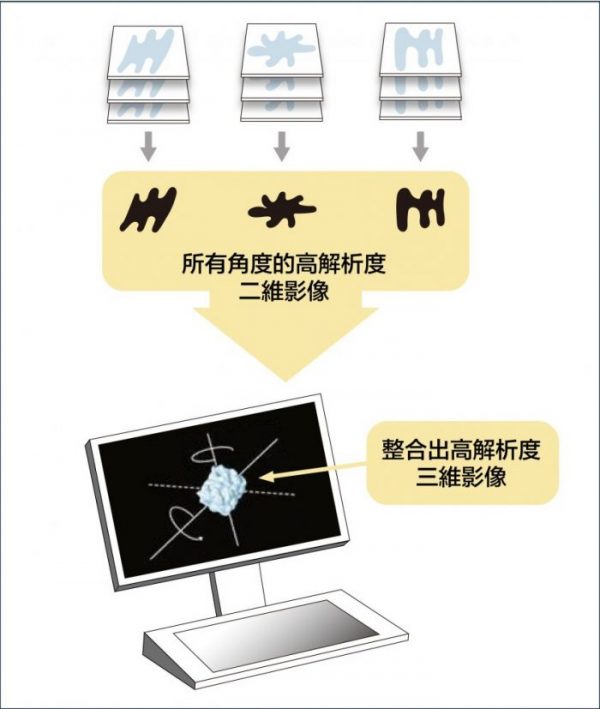
不過,生物分子製備成樣本,排列的角度是隨機的,拍攝的影像是二維,怎麼組合成三維的分子結構呢?美國學者法蘭克 (Joachim Frank) 發展出一種演算法,可將不同角度的二維影像分類與整合、自動合成出三維圖像。
圖│研之有物 (資料來源│pdf)
圖│研之有物 (資料來源│pdf)
關關難過關關過!科學家就這樣逐一克服冷凍電顯技術的難題。隨著技術與零組件的持續精進,冷凍電顯技術成為今日研究生物分子最具潛力的新興技術。2017 年諾貝爾化學獎,即由韓德森、杜波克特和法蘭克三人共享。
結構生物學發展初期,研究蛋白質等生物分子的主力是 X 射線晶體學(X-ray crystallography, XRC),只能觀測結晶後的生物分子。
1950 年代起,X 射線晶體學問世!科學家利用 X 射線照射結晶後的生物分子,由於生物分子的結晶會使 X 射線繞射,只要觀測繞射後的 X 射線紋路,就可經由數學方法計算出晶體的結構。
然而 ,X 射線晶體技術觀察的生物分子,本身必須能形成分子排列整齊的晶體,但不是所有蛋白質都能形成晶體。即使可以,很多蛋白質分子必須在特定的酸鹼和溫度等環境條件下才會結晶。研究者想要觀察生物分子在不同環境下的結構變化,往往缺乏分子晶體而無法如願。
核磁共振光譜法(Nuclear Magnetic Resonance Spectroscopy, NMR),可研究液體樣本,但較適用小分子。
核磁共振光譜法,是將樣本放置在磁場中,利用樣本中有些原子核 (如 1H 和 13C 等)可與磁場共振,先吸收強磁場,再放出電磁波。因為分子不同,可共振的原子核數量、位置都不一樣,因此釋放出的不同電磁波訊號。研究者可從接收的電磁波訊號,反推這些原子核在分子內的數量與分布。
1980年代起,核磁共振光譜法廣泛運用在觀察溶液中比較小的生物分子,例如:比較小的蛋白分子、RNA 結構或是構築生物膜的脂質分子。但就像一把雙面刃,核磁共振光譜法難以觀測較大、較複雜的生物分子。
質譜法(mass spectrometry, MS),透過量測帶電粒子質量/電荷(m/z)比值的方式,了解物質的組成,無法「看見」物質的立體結構。
早在 1913 年,科學家就已提出質譜法。近二十年來,開始運用質譜法分析生物分子,例如正常細胞與癌細胞的差異,作為判斷癌症等疾病的輔助分析。但質譜法只能告訴我們物質的種類與數量,無法幫助我們解析物質的三維樣貌。
總括而論,既有三項技術雖揭開大量生物分子結構的奧秘,但都有限制與改善的空間。而冷凍電顯的問世,正克服了過去技術的限制,而開拓了結構生物學研究的視野。可惜的是,在生物技術研究的國際浪潮中,過去我國相關技術的建置速度,仍略遜國際科研大國。
2000 年起,因為「基因體醫學國家型科技計畫」支持,以及後續計畫經費的持續挹注,中研院陸續購入 X 射線晶體學、核磁共振光譜法,以及質譜法等儀器。2018 年 9 月,蔡明道團隊建置完成了國內首創的冷凍電顯中心。

圖│研之有物
至此,中研院結構生物研究的四大神器已然完整到位,取得與頂尖國際研究團隊競爭的門票!
冷凍電顯中心研究什麼?
「冷凍電顯技術可以克服其他儀器的限制,在可預期的未來,勢必慢慢成為主流研究方式。」蔡明道院士堅定地說。
2019 年 4 月,在冷凍電顯中心設立短短半年後,長期投入酵素研究的蔡明道院士與中央大學生科系陳青諭老師,利用冷凍電子顯微術,觀察 KARI 酵素在原子尺度的結構,並在不破壞酵素且提高實驗效率的情況下,研究 KARI 酵素的活性如何受到酸鹼環境的影響。
這是國際上第一篇利用高解析度冷凍電顯結構來探討酶學的論文,引發關注。
這是因為 KARI 酵素與生質燃料的生產有密切關係,這項研究不只有助於理解生物機制的奧秘,還可能進入工業運用,實際解決當代能源危機與減碳難題。
除了理解生物分子結構,蔡明道院士認為冷凍電顯更重要的研究方向是:將過去生物學家對生物分子功能的理解,結合化學家對原分子尺度化學反應的理解,讓科學家更了解生化反應的機制。
除了長期投入的酵素研究以外,冷凍電顯中心可配合中研院專精的醣科學研究,以原子級的高解析度觀測蛋白質上的醣結構。或是對於疾病管制影響甚鉅的病毒研究,過去傳統上判定病毒或判斷生物是否感染病毒,常常利用血液中該病毒抗體的數量來間接推測。目前,蔡明道院士也與成大醫學中心的團隊合作,研究傳染病毒的微結構,協助疫苗研發。
台灣蛋白質計畫的野望
在 2017 年諾貝爾化學獎的加持下,今天冷凍電顯技術已是學術界人人追求的神器。
早在諾貝爾化學獎公布之前,2016 年下半年,蔡明道院士已經洞見時代的浪潮,規劃中研院冷凍電顯中心的建置。在中研院的支持下,很快地,在 2017 年 3 月訂購了儀器,經過一年半的建置與人才培訓,在 2018 年 9 月完成建置。
冷凍電顯中心的建置,不只是取得與國際競爭的門票,蔡明道院士也戮力於優秀人才發掘與培養。
以冷凍電顯技術的 PI 和儀器經理來說,因為相關人才稀少又熱門,難以招募到已有相關經驗的外籍學者。蔡明道院士帶著國內結構生物學的研究人員,透過自學與參與國外課程、研究計畫等方式,訓練自己的技術人才。如今,中心已建置四台不同級別的冷凍電子顯微鏡,可供應初階使用者訓練、初階研究,自動化中高階研究與自動化高階研究。
此外,冷凍電顯技術的建置與人力成本高昂,最高階使用費用更需每日一萬四千元,年輕研究者的計畫經費往往難以支付。因此,蔡明道院士所主持的「台灣蛋白質計畫」,主動尋覓相關領域的優秀年輕研究者,不只是提供經費與儀器資源,更參與研究方向與科學探索的知識辯證,達到研究與知識的合作與傳承。
近期,台灣蛋白質計畫也著手於產學合作的發展。蔡明道院士認為蛋白質研究本身複雜度且難度夠高,研究內容也夠新穎,所需的儀器與知識,業界難以自行承擔。所以應由業界提出難度極高的問題,交由學術界研發解答,以充分發揮學術界的優勢與特性。
蔡明道院士打造的冷凍電顯中心,不僅是在儀器使用上能做到便利研究者的一體化服務,而是將厚植國家科研能力、協助產業發展、培養年輕研究人才等等崇高理想,耦合而成的知識傳承典範。

圖│廖英凱